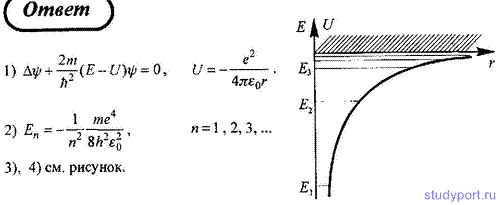
128. Представьте: 1) уравнение Шредингера для стационарных состояний электрона, находящегося в атоме водорода; 2) собственные значения энергии, удовлетворяющие уравнению; 3) график потенциальной энергии взаимодействия электрона с ядром; 4) возможные дискретные значения энергии на этом графике.
130. Волновая функция ψnlml (r,ν,φ), описывающая атом водорода, определяется главным квантовым числом n, орбитальным квантовым числом l и магнитным квантовым числом ml. Определите, чему равно число различных состояний, соответствующих данному n.

131. Запишите возможные значения орбитального квантового числа l и магнитного квантового числа ml для главного квантового числа n = 4.

132. Определите, сколько различных волновых функций соответствует главному квантовому числу n = 3.
135. Постройте и объясните диаграмму, иллюстрирующую расщепление энергетических уровней и спектральных линий (с учетом правил отбора) при переходах между состояниями с l = 2 и l = 1.

137. Волновая функция, описывающая 1s-состояние электрона в атоме водорода, имеет вид ψ(r) = C*e-r/a, где r — расстояние электрона от ядра, a — первый боровский радиус. Определите нормированную волновую функцию, отвечающую этому состоянию.

138. Предполагая, что нормированная волновая функция, описывающая 1s-состояние электрона в атоме водорода, известна (см. задачу 137), определите среднее значение функции 1/r, принимая во внимание, что <1/r> = интеграл(1/rψ*ψdV).

139. Нормированная волновая функция, описывающая 1s-состояние электрона в атоме водорода, имеет вид ψ100(r) = 1/корень(πa3)*e-r/a, где a—первый боровский радиус. Определите: 1) вероятность W обнаружения электрона на расстоянии от r до r + dr от ядра; 2) расстояния от ядра, на которых электрон может быть обнаружен с наибольшей вероятностью.
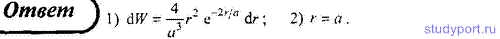
140. Нормированная волновая функция, описывающая 1s-состояние электрона в атоме водорода, имеет вид ψ100(r) = 1/корень(πa3)*e-r/a, где a — первый боровский радиус. Определите среднюю потенциальную энергию электрона в поле ядра.

141. Нормированная волновая функция, описывающая 1s -состояние в атоме водорода, имеет вид ψ100(r) = 1/корень(πa3)*e-r/a, где a — первый боровский радиус. Определите среднее значение модуля кулоновской силы, действующей на электрон.

142. Электрон в атоме находится в f-состоянии. Определите возможные значения (в единицах h) проекции момента импульса Llz орбитального движения электрона в атоме на направление внешнего магнитного поля.
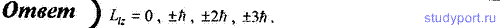
143. Электрон в атоме находится в d-состоянии. Определите: 1) момент импульса (орбитальный) Ll электрона; 2) максимальное значение проекции момента импульса (Llz)max на направление внешнего магнитного поля.

144. Определите, во сколько раз орбитальный момент импульса Ll электрона, находящегося в f-состоянии, больше, чем для электрона в p-состоянии.
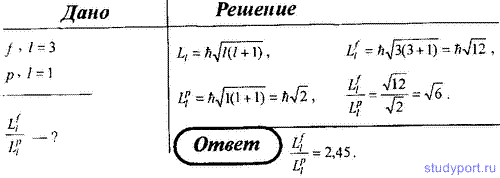
145. 1s электрон атома водорода, поглотив фотон с энергией E = 12,1 эВ, перешел в возбужденное состояние с максимально возможным орбитальным квантовым числом. Определите изменение момента импульса ΔLl орбитального движения электрона.
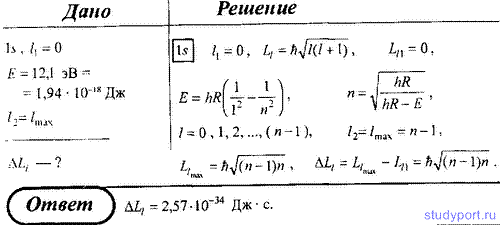
148. Определите числовое значение 1) собственного механического момента импульса (спина) Ls; 2) проекции спина Lsz на направление внешнего магнитного поля.
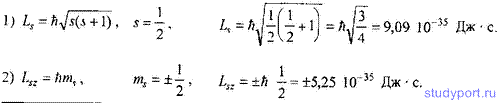
151. Учитывая принцип Паули, определите максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом.
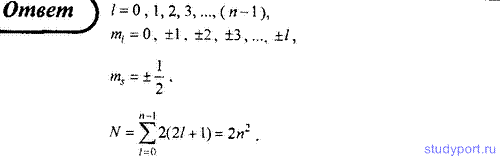
152. Заполненной электронной оболочке соответствует главное квантовое число n = 3 . Определите число электронов на этой оболочке, которые имеют одинаковые квантовые числа: 1) ms = -1/2 ; 2) ml = 0; 3) ml = -1, ms = 1/2.

153. Заполненной электронной оболочке соответствует главное квантовое число n = 4. Определите число электронов на этой оболочке которые имеют одинаковые квантовые числа: 1) ml = -3; 2) ms = 1/2, l = 2 ; 3) ms = -1/2 , ml = 1.

154. Определите суммарное максимальное число s-, p-, d-, l- и g-электронов, которые могут находиться на N- и O-оболочках атома.

155. Запишите квантовые числа, определяющие внешний, или валентный, электрон в основном состоянии атома натрия.


