2.1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ
● Закон Бойля-Мариотта
рV = const при Т = const, m = const,
где р – давление; V – объем; Т – термодинамическая температура; m – масса газа.
● Закон Гей-Люссака
V =V0 (1+ αt) , или V1 /V2 = T1 /T2
при p = const, m = const;
p = p0 (1+ αt) , или p1 / p2 =T1 /T2
при V = const, m = const,
где t – температура по шкале Цельсия; V0 и p0 – соответственно объем и давление при 0 °С; коэффициент α =1/ 273 К−1 ; индексы 1 и 2 относятся к произвольным состояниям.
● Закон Дальтона для давления смеси n идеальных газов
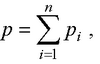
где pi – парциальное давление i-го компонента смеси.
● Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
pVm = RT (для одного моля газа),
pV = (m/M)RT (для произвольной массы газа),
где Vm – молярный объем; R – молярная газовая постоянная; M – молярная масса газа; m – масса газа; m/M = ν – количество вещества.
● Зависимость давления газа от концентрации n молекул и температуры
p = nkT ,
где k – постоянная Больцмана ( k = R/ NA , NA – постоянная Авогадро).
● Основное уравнение молекулярно-кинетической теории идеальных газов
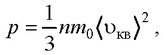
или
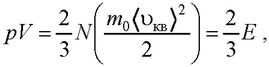
или
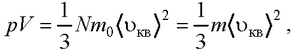
где 〈 υкв 〉 – средняя квадратичная скорость молекул; Е – суммарная кинетическая энергия поступательного движения всех молекул газа; n – концентрация
молекул, m0 – масса одной молекулы; m = Nm0 – масса газа; N – число молекул в объеме газа V.
● Скорость молекул:
– наиболее вероятная
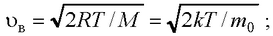
– средняя квадратичная
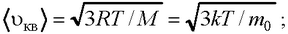
– средняя арифметическая
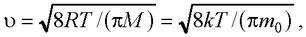
где m0 – масса одной молекулы.
● Средняя кинетическая энергия поступательного движения молекулы идеального газа
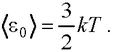
● Закон Максвелла для распределения молекул идеального газа по скоростям
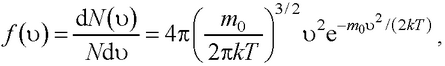
где функция f (υ) распределения молекул по скоростям определяет относительное число молекул dN(υ)/ N из общего числа N молекул, скорости которых лежат в интервале от υ до υ + dυ .
● Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
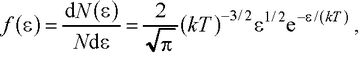
где функция f (ε) распределения молекул по энергиям теплового движения определяет относительное число молекул dN(ε)/ N из общего числа N молекул, которые имеют кинетические энергии ε = m0υ2 / 2 , заключенные в интервале от ε до ε + dε.
● Барометрическая формула
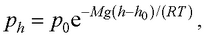
где ph и p0 – давление газа на высоте h и h0 .
● Распределение Больцмана во внешнем потенциальном поле
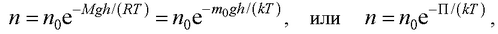
где n и n0 – концентрация молекул на высоте h и h = 0 ; П = m0gh – потенциальная энергия молекулы в поле тяготения.
● Среднее число соударений, испытываемых молекулой газа за 1 с,
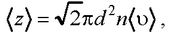
где d – эффективный диаметр молекулы; п – концентрация молекул; 〈υ〉 – средняя арифметическая скорость молекул.
● Средняя длина свободного пробега молекул газа
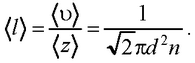
● Закон теплопроводности Фурье
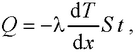
где Q – теплота, прошедшая посредством теплопроводности через площадь S за время t; dT / dx – градиент температуры; λ – теплопроводность:
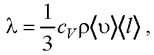
где cV – удельная теплоемкость газа при постоянном объеме; ρ – плотность газа; 〈υ〉 – средняя арифметическая скорость теплового движения его молекул; 〈l〉 – средняя длина свободного пробега молекул.
● Закон диффузии Фика
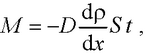
где М – масса вещества, переносимая посредством диффузии через площадь S за время t; dρ/ dx – градиент плотности, D – диффузия:
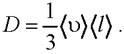
● Закон Ньютона для внутреннего трения (вязкости)

где F – сила внутреннего трения между движущимися слоями площадью S; dυ/ dx – градиент скорости; η – динамическая вязкость:
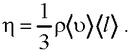
2.2. ОСНОВЫ ТЕРМОДИНАМИКИ
● Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы,
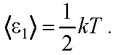
● Средняя энергия молекулы
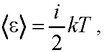
где i – сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы (i = nпост + nвращ + 2nколеб ).
● Внутренняя энергия идеального газа
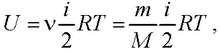
где ν – количество вещества; m – масса газа; М – молярная масса газа; R – молярная газовая постоянная.
● Первое начало термодинамики
Q = ΔU + A ,
где Q – количество теплоты, сообщенное системе или отданное ею; ΔU – изменение ее внутренней энергии; А – работа системы против внешних сил.
● Первое начало термодинамики для малого изменения системы
dQ = dU + δA.
● Связь между молярной Cm и удельной с теплоемкостями газа
Cm = cM ,
где М – молярная масса газа.
● Молярные теплоемкости газа при постоянном объеме и постоянном давлении
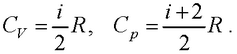
● Уравнение Майера
Cp = CV + R .
● Изменение внутренней энергии идеального газа
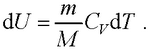
● Работа, совершаемая газом при изменении его объема,
δA = pdV .
● Полная работа при изменении объема газа
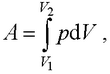
где V1 и V2 – соответственно начальный и конечный объемы газа.
● Работа газа:
– при изобарном процессе
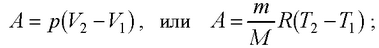
– при изотермическом процессе
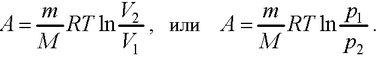
● Уравнение адиабатического процесса (уравнение Пуассона)
pV γ = const , TVγ−1 = const , Tγ p1−γ = const ,
где γ = Cp /CV = (i + 2)/ i – показатель адиабаты.
● Работа в случае адиабатического процесса
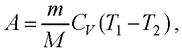
или
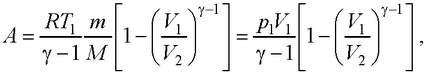
где T1 , T2 и V1 , V2 – соответственно начальные и конечные температура и объем газа.
● Термический коэффициент полезного действия для кругового процесса (цикла)
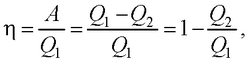
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
● Термический коэффициент полезного действия цикла Карно
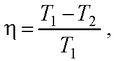
где T1 – температура нагревателя; T2 – температура холодильника.
● Изменение энтропии при равновесном переходе из состояния 1 в состояние 2
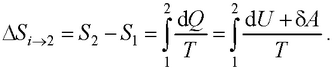
2.3. РЕАЛЬНЫЕ ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ТЕЛА
● Уравнение состояния реальных газов (уравнение Ван-дер-Ваальса) для моля газа
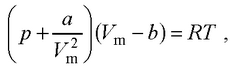
где Vm – молярный объем; а и b – постоянные Ван-дер-Ваальса, различные для разных газов.
● Уравнение Ван-дер-Ваальса для произвольной массы газа
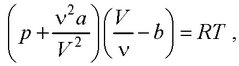
или
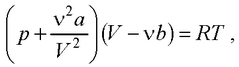
где ν = m / М – количество вещества.
● Внутреннее давление, обусловленное силами взаимодействия молекул,
p′ = a /Vm2 .
● Связь критических параметров (объема, давления и температуры) с постоянными а и b Ван-дер-Ваальса
Vk = 3b, pk = a /(27b2), Tk = 8a /(27Rb).
● Внутренняя энергия реального газа
U = ν (CVT − a /Vm) ,
где CV – молярная теплоемкость газа при постоянном объеме.
● Энтальпия системы
U1 + p1V1 =U2 + p2V2 ,
где индексы 1 и 2 соответствуют начальному и конечному состояниям системы.
● Поверхностное натяжение
σ = F / l , или σ = ΔE / ΔS ,
где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости; ΔЕ – поверхностная энергия, связанная с площадью ΔS поверхности пленки.
Δp = σ (1/ R1 + 1/ R2) ,
где R1 и R2 – радиусы кривизны двух взаимно перпендикулярных нормальных сечений поверхности жидкости; радиус кривизны положителен, если центр кривизны находится внутри жидкости (выпуклый мениск), и отрицателен, если центр кривизны находится вне жидкости (вогнутый мениск). В случае сферической поверхности
Δp = 2σ / R .
● Высота подъема жидкости в капиллярной трубке
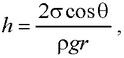
где θ – краевой угол; r – радиус капилляра; р – плотность жидкости; g – ускорение свободного падения.
● Закон Дюлонга и Пти
CV = 3R ,
где CV – молярная (атомная) теплоемкость химически простых твердых тел.
● Уравнение Клапейрона-Клаузиуса, позволяющее определить изменение температуры фазового перехода в зависимости от изменения давления при равновесно протекающем процессе,
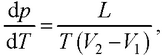
где L – теплота фазового перехода; (V2 −V1) – изменение объема вещества при переходе его из первой фазы во вторую; Т – температура перехода (процесс изотермический).

